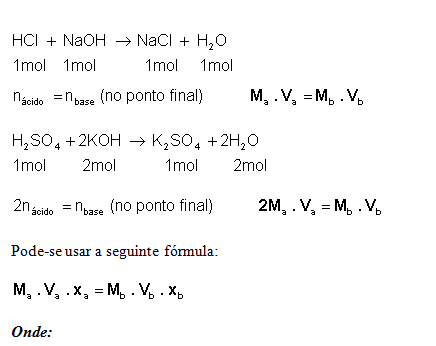Cálculos de diluição e mistura de soluções
Diluição é o ato físico-químico de tornar uma solução menos concentrada em partículas de soluto através do aumento do solvente (número de vezes que a concentração da solução vai diminuir).As soluções são misturas homogêneas formadas pelo soluto (aquele que é dissolvido) e o solvente (aquele que dissolve). Diluir uma solução consiste em adicionar a ela uma porção de solvente puro. Portanto, neste trabalho visa-se abordar sobre o tema “cálculos de diluição e mistura de soluções”.
Cálculos de diluição e mistura de soluções
Diluição
Consiste em adicionar mais solvente puro a uma determinada solução.A massa de uma solução após ser diluída permanece a mesma, não é alterada, porém a sua concentração e o volume se alteram. Enquanto o volume aumenta, a concentração diminui. Veja a fórmula:
Onde:
M1 = molaridade da solução 1
M2 = molaridade da solução 2
V1 = volume da solução 1
V2 = volume da solução 2
Para esta fórmula, sempre M1 e V1 são mais concentrados e M2 e V2 são mais diluídos.
Exemplo:
Um químico deseja preparar 1500mL de uma solução 1,4mol/L de ácido clorídrico (HCl), diluindo uma solução 2,8mol/L do mesmo ácido. Qual o volum de solução que havia na primeira solução a ser diluída?
Dados:
Observe que as unidades de volume foram mantidas em mL. Se uma das unidades for diferente, deve-se transformar para litros.
Mistura De Soluções
De mesmo soluto: na mistura de soluções de mesmo soluto não há reação química entre estas soluções. Neste caso, o valor do volume final é a soma das soluções.
Onde:
C = concentração comum (g/L)
M = molaridade (mol/L)
V = volume (L)
Exemplo:
Qual a molaridade de uma solução de NaOH formada pela mistura de 60mL de solução a 5mol/L com 300mL de solução a 2mol/L?
De diferente soluto que reagem entre si: ocorre reação entre as substâncias que compõe a mistura. Para que a reção seja completa entre os solutos, os volumes misturados devem obedecer a proporção estequiométrica que corresponde à reação química.
Reacção de Neutralização:
Onde:
xa = número de H+
xb= número de OH-
Estes cálculos também podem ser feitos por regra de três e utilizando as outras fórmulas.
Exemplo:
Juntando-se 300mL de HCl0,4mol/L com 200mL de NaOH0,6mol/L, pergunta-se quais serão as molaridades da solução final com respeito:
- ao ácido:
- à base:
- ao sal formado:
Montar a reacção química:
Calcular n (número de mol) do ácido e da base:
Se forma 0,12mol de ácido e também de base e a proporção estequiométrica é 1:1, então a molaridade final de ácido e de base é zero porque reagiu todo o soluto.
Calcular a molaridade do sal:
Antes achar o volume final:
Titulação
Método de análise volumétrica que consiste em determinar a concentração de ácido ou de base atravpes de um volume gasto de uma das soluções com molaridade conhecida.
Este método é muito utilizado em laboratórios químicos e é utilizado as seguintes vidrarias e reagentes:
- erlenmeyer (vidro usado para guardar e preparar soluções);
- bureta (tubo de vidro graduado em milímetros com torneira;
- indicador ácido-base (fenolftaleína, alaranjado de metila, etc).
Na bureta, coloca-se a solução de concentração conhecida, a qual é adicionada a uma alíquota (porção) da solução com concentração a ser determinada.
O momento em que o indicador muda de cor chamamos de ponto de final ou ponto de equivalência. Anota-se o volume gasto na bureta. Atraves deste volume podemos estabelecer as quantidades, em mol, que reagiram entre si.
Cálculos de Diluições
Antes de entender os cálculos sobre diluição de soluções,é imprescindível conhecer quais são as formas de realizar esse processo. As duas formas de diluir uma solução são:
- Adição de solvente em uma solução pronta (adicionar água, por exemplo, ao suco de caju concentrado).
Observação: Quando uma solução pronta recebe um novo volume de solvente, ela passa a ter uma quantidade de solvente muito maior em relação ao soluto. Por isso, ela se torna uma solução menos concentrada ou mais diluída que a inicial.
- Retirada de solvente de uma solução pronta (quando deixamos, por exemplo, uma sopa mais tempo no fogo para que parte de sua água evapore).
Observação: Quando uma solução pronta perde parte do seu solvente por evaporação, ela passa a ter uma quantidade de solvente próxima à quantidade de soluto. Por isso, ela se torna uma solução mais concentrada ou menos diluída que a inicial.
Em ambos os casos, as fórmulas que podemos utilizar para realizar os cálculos sobre diluições são:
- Ci.Vi = Cf.Vf
- Ci = concentração comum inicial;
- Vi = volume inicial;
- Cf = concentração comum final;
- Vf = volume final.
- Mi.Vi = Mf.Vf
- Mi = molaridade inicial;
- Vi = volume inicial;
- Mf = molaridade final;
- Vf = volume final.
O volume final é a soma do volume inicial ao volume adicionado (Va) ou a subtração do volume inicial pelo volume evaporado (Ve).
Vf = Vi + Va ou
Vf = Vi - Ve
|
1º) Um químico possuía uma solução de concentração 1000 mg/L e deveria diluí-la até que sua concentração fosse reduzida para 5,0 mg/L, em um volume de 500 mL. Qual será o volume de água que ele deverá adicionar à solução inicial para obter o valor pretendido?
Dados do exercício:
Ci = 1000 mg/L
Vi = volume inicial
Cf = 5 mg/L
Vf = 500 mL
Para resolver a questão, devemos determinar o volume inicial pela seguinte fórmula:
Ci.Vi = Cf.Vf
1000. Vi = 5.500
1000Vi = 2500
Vi = 2500
1000
Vi = 2,5 mL
Como o exercício pede o volume de água adicionado, utilizamos:
Vf = Vi + Va
500 = 2,5 + Va
Va = 500 – 2,5
Va = 497,5 mL de água
2º) A partir de uma solução aquosa de KOH, cuja concentração inicial é de 20 g/L, deseja-se obter 150 mL de uma solução de 7,5 g/L. Determine, em litros, o volume da solução inicial necessária para essa diluição.
Dados do exercício:
Ci = 20 g/L
Vi = volume inicial
Cf = 7,5 g/L
Vf = 150 mL
Para resolver a questão, devemos determinar o volume inicial pela seguinte fórmula:
Ci.Vi = Cf.Vf
20. Vi = 7,5.150
20Vi = 1125
Vi = 1125
20
Vi = 56,25 mL
Como o exercício pede o volume em litros, basta dividir o valor encontrado por mil:
Vi = 56,25
1000
Vi = 0,05625 L
3º) Determine o volume em litros de água que foi evaporado de uma solução 2,0 mol/L de NaOH, que possuía 200 mL, para que sua concentração fosse elevada para 4,5 mol/L.
Dados do exercício:
Mi = 2 mol/L
Vi = 200 mL
Mf = 4,5 mol/L
Vf = ?
Para resolver a questão, devemos determinar o volume final pela seguinte fórmula:
Mi.Vi = Mf.Vf
2.200 = 4,5.Vf
400 = 4,5Vf
Vf = 400
4,5
Vf = 88,88 mL
Como o exercício deseja o volume de água evaporado, utilizamos:
Vf = Vi - Ve
88,88 = 200 - Ve
Ve = 200 – 88,88
Ve = 111,12 mL de água evaporada
4º) Adicionando-se 75mL de água a 25mL de uma solução 0,20M de cloreto de sódio, obteremos uma solução cuja concentração molar será igual a quanto?
Dados do exercício:
Mi = 0,20 M
Vi = 25 mL
Va = 75 mL
Mf = ?
Vf = é a soma do Vi (25mL) com o Va (75 mL); logo, o Vf será 100 mL.
Para resolver a questão, devemos determinar a molaridade final:
Mi.Vi = Mf.Vf
0,2.25 = Mf.100
5 = Mf.100
Mf = 5
100
Mf = 0,05 mL
Conclusão
Terminado trabalho, pudemos concluir que em laboratórios químicos e em indústrias, esse processo é muito importante, porque o químico precisa preparar soluções com concentrações conhecidas. Além disso, em atividades experimentais são utilizadas soluções com concentrações bem baixas, assim, uma amostra da solução concentrada é diluída até a concentração desejada.
No dia-a-dia, várias vezes, até sem perceber, realizamos o processo de diluição de soluções. Por exemplo, a embalagem de produtos de limpeza e higiene doméstica, como desinfetantes, orienta que eles sejam diluídos antes de sua utilização. Alguns fabricantes sugerem nos rótulos do produto que ele seja diluído em água na proporção de 1 para 3, ou seja, para cada parte do produto, devem-se acrescentar 3 partes de água. Isso é feito, pois o produto é muito concentrado e forte, podendo danificar o local onde será aplicado se não for diluído da maneira certa. Por outro lado, se diluir mais do que deveria, pode-se perder dinheiro, porque o produto não atingirá o resultado desejado.
Bibliografia
- QUÍMICA - 12.ª CLASSE
- Teresa Sobrinho Simões, Maria Alexandra Queirós, Maria Otilde Simões
- Editora: Plural Editores Moçambique
- Última Edição: 2014
- Encadernação: Capa mole
- Dimensões: 198 x 273 x 15 mm
Encomende já o seu trabalho!!!
+258 84 67 22 756